SOLUCIONES
Una solución o también llamada disolución es una mezcla homogénea de 2 o más sustancias. Una solución esta compuesta por un solvente o disolvente (el cual se encuentra generalmente en mayor cantidad), y un soluto (menor cantidad).
Existen soluciones coloidales en donde las partículas son de 10 a 1000 veces mayores que un átomo.
Las soluciones pueden encontrarse en los siguientes estados físicos:
- sólido-sólido
- sólido-líquido
- gas-gas
- gas-líquido
- gas-sólido
- líquido-líquido
Existen varias maneras de preparar soluciones con respecto a la concentración:
PORCENTUALES
Podemos encontrar tres casos peso-volumen por ejemplo preparar una solución de NaCl al 5% en agua; ésto es 5 gr de NaCl más agua necesaria para llevarlo a 100 ml en total.
En el caso de peso-peso por ejemplo, preparar una solución de NaCl en azúcar; ésto es 5 gr de NaCl más sacarosa suficiente para tener un total de 100gr de solución.
Finalmente para el caso de volumen-volumen preparar una solución de alcohol al 70% en agua; ésto es 70 ml de alcohol más agua suficiente para tener un total de 100 ml.
MOLARES
Sabemos que una mol de un átomo es  de átomo, y que un molar es la masa molecular de una molecula y al mismo tiempo la masa de un átomo.
de átomo, y que un molar es la masa molecular de una molecula y al mismo tiempo la masa de un átomo.
 de átomo, y que un molar es la masa molecular de una molecula y al mismo tiempo la masa de un átomo.
de átomo, y que un molar es la masa molecular de una molecula y al mismo tiempo la masa de un átomo. La molaridad se define como el número de moles de soluto por litro de solución (también como el número de mili moles de soluto por mililitro de solución):
Las soluciones molares SON AFECTADAS por la temperatura.
NORMALIDAD
La normalidad se define como número de equivalentes por litros de disolución. La normalidad se expresa así:
En este caso, los equivalentes pueden expresarse de la siguiente forma:
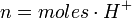 para un ácido, o
para un ácido, o  para una base.
para una base.
MOLALIDAD
 Es la unidad de concentración preferida en estudios de cambios de temperatura. La molalidad (m) es el número de moles de soluto que contiene un kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitado y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.
Es la unidad de concentración preferida en estudios de cambios de temperatura. La molalidad (m) es el número de moles de soluto que contiene un kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitado y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor.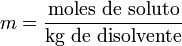
La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión.
REFERENCIAS
Elizabeth Pérez Rodríguez



